عناصر و نامهای جدول تناوبی
بسمه تعالی
ای نام تو بهترین سر آغاز بی نام تو نامه کی کنم باز
با نام خدا اغاز میکنیم که سرچشمه هستی است ,, هر انچه که هست از اوست .
به نام او که از ابتدای خلقت راه زندگی را به بشر اموخت و در هر برهه ای از زمان به نسبت نیاز بشر علم استفاده از مواهب و نعمتهای نازل شده بر زمین و اسمان و جهان هستی را آموخت .
و اینک پس از مقدمه علم متالورژی و توضیح جدول مندلیف, اینک قصد آن داریم که عناصر و نامهای جدول تناوبی را در یک جدول جدید با ذکر نام و قابلیتهای هر ردیف از جدول را به اختصار نوضیح داده و نام و مختصری از زندگانی دانشمندانی که در این جدول تناوبی عنصری به نامشان ثبت شده را نیز بیان کنیم .
ما به صراحت و مکرر اعلام میکنیم ,, خادمان به بشر از این ماده وعناصر حیاتی برای بقاء انسانها و خائنان برای نابودی مخلوقات خداوند استفاده میکنند.
از خداوند توفیق ان داریم که همواره جزء خادمان بشریت باشیم.
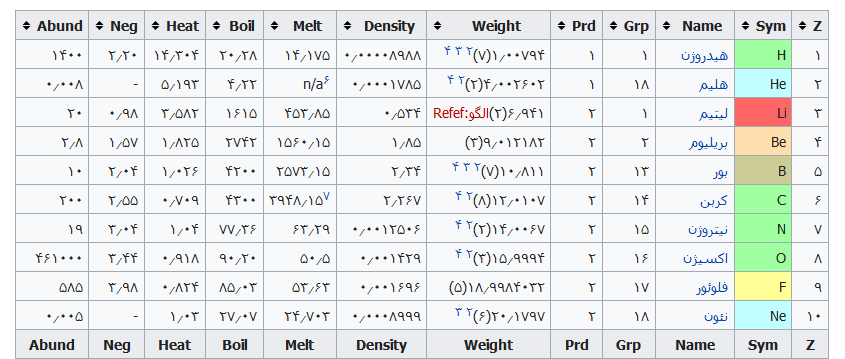
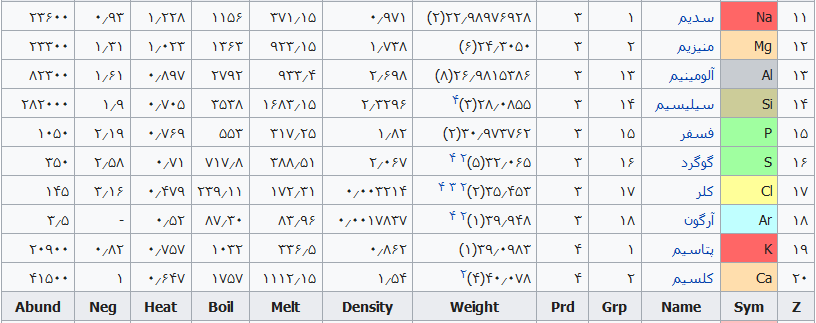
در جدول زیر معنی نام عناصر جدول تناوبی ذکر شده است. جدول به ترتیب عدد اتمی عناصر فهرست شده است.
| عدد اتمی | عنصر | معنی نام |
| ۱ | هیدروژن (H) | ترکیبی است از Hydro+Genes به معنای مولد آب. |
| ۲ | هلیم (He) | از واژه Helios به معنای خورشید گرفته شده است. |
| ۳ | لیتیم (Li) | از واژه Lithos به معنای سنگ گرفته شده است. |
| ۴ | بریلیوم (Be) | از واژه Beryllos به معنای سنگ معدنی بریل گرفته شده است. |
| ۵ | بور (B) | از واژه عربی و فارسی بوراکس (درخشان) گرفته شده است. |
| ۶ | کربن (C) | به علت ساختار زغال از واژه Carbo به معنای زغال گرفته شده است. |
| ۷ | نیتروژن (N) | ترکیبی از کلمات Nitron+genes است که به معنای مولد سودا می باشد. |
| ۸ | اکسیژن (O) | ترکیبی از کلمات Oxys + genes است که به معنای مولد اسید می باشد. |
| ۹ | فلوئور (F) | ازواژه Fluere به معنی جریان گرفته شده است. |
| ۱۰ | نئون (Ne) | از واژه Neos به معنای جدید گرفته شده است. |
| ۱۱ | سدیم (Na) | از واژه Sodanum به معنای علاج سردرد گرفته شده است. |
| ۱۲ | منیزیم (Mg) | از واژه مگنزیای باستان در منطقه ی تسالی یونان گرفته شده است. |
| ۱۳ | آلومینیوم (Al) | از واژه Alumen یا Aluminis به معنای زاج گرفته شده است. |
| ۱۴ | سیلیسیم (Si) | از واژه Silex به معنای سنگ چخماق گرفته شده است. |
| ۱۵ | فسفر (P) | از واژه Phosphoros به معنای آورنده ی نور گرفته شده است. |
| ۱۶ | گوگرد (S) | از واژه Sulphur به معنای گوگرد گرفته شده است. |
| ۱۷ | کلر (Cl) | از واژه Chloros به معنای زرد مایل به سبز گرفته شده است. |
| ۱۸ | آرگون (Ar) | از واژه Argos به معنای غیرفعال گرفته شده است. |
| ۱۹ | پتاسیم (K) | از واژه Pot ash به معنای خاکستر ظرف گرفته شده است. زیرا آن را در ترکیب خاکستر یافتند. |
| ۲۰ | کلسیم (Ca) | از واژه Calx به معنای آهک گرفته شده است. |
| ۲۱ | اسکاندیم (Sc) | از نام کشورهای اسکاندیناوی گرفته شده است. |
| ۲۲ | تیتانیوم (Ti) | به معنی کره زمین. |
| ۲۳ | وانادیم (V) | از واژه Vanadís که یکی از اساطیر اسکاندیناوی است گرفته شده است. |
| ۲۴ | کروم (Cr) | از واژه یونانی chróma به معنی رنگ گرفته شده است. |
| ۲۵ | منگنز (Mn) | از کلمه لاتین Magnesia که شهری باستانی است گرفته شده است. |
| ۲۶ | آهن (Fe) | به معنی فلز قوی. |
| ۲۷ | کبالت (Co) | به معنی روح شیطانی. |
| ۲۸ | نیکل (Ni) | از واژه سوئدی kopparnickel (سنگ معدن مس) گرفته شده است. |
| ۲۹ | مس (Cu) | به معنی چیزی که از قبرس(Cyprus) آمده است. |
| ۳۰ | روی (Zn) | – |
| ۳۱ | گالیم (Ga) | از واژه Galia به معنای فرانسه گرفته شده است. |
| ۳۲ | ژرمانیم (Ge) | از واژه Germania به معنای کشور آلمان گرفته شده است. |
| ۳۳ | آرسنیک (As) | از واژه Arsenium به معنای رنگدانه محبوب زرد گرفته شده است. |
| ۳۴ | سلنیم (Se) | از واژه Selene به معنای ماه گرفته شده است. |
| ۳۵ | برم (Br) | به علت بوی بد آن از واژه Bromos به معنای تعفن گرفته شده است. |
| ۳۶ | کریپتون (Kr) | از واژه Kryptos به معنی پنهان گرفته شده است. |
| ۳۷ | روبیدیم (Rb) | از واژه Rubidus به معنای قرمز سیر گرفته شده است. |
| ۳۸ | استرانسیم (Sr) | از واژه Strontian که شهری است در اسکاتلند گرفته شده است. |
| ۳۹ | ایتریم (Y) | از نام روستای Ytterby گرفته شده است. |
| ۴۰ | زیرکونیوم (Zr) | از واژه فارسی زرگون یا عربی زرکون به معنی شبیه طلا گرفته شده است. |
| ۴۱ | نیوبیم (Nb) | به معنی برفی. |
| ۴۲ | مولیبدن (Mo) | به معنی شبیه سرب. |
| ۴۳ | تکنسیم (Tc) | به معنی مصنوعی. |
| ۴۴ | روتنیم (Ru) | – |
| ۴۵ | رودیم (Rh) | به معنی گل رز. |
| ۴۶ | پالادیم (Pd) | به معنی پسران کوچک. |
| ۴۷ | نقره (Ag) | – |
| ۴۸ | کادمیم (Cd) | – |
| ۴۹ | ایندیم (In) | به علت رنگ آن از واژه Indicum به معنای رنگ نیلی گرفته شده است. |
| ۵۰ | قلع (Sn) | از واژه Tinia به معنی خدای اتروسکن گرفته شده است. |
| ۵۱ | آنتیموان (Sb) | ترکیبی است از کلمات Anti+monos به معنای غیرتنها گرفته شده است. |
| ۵۲ | تلوریم (Te) | از واژه Tellus به معنای زمین گرفته شده است. |
| ۵۳ | ید (I) | از واژه Ioeides به معنای بنفش رنگ گرفته شده است. |
| ۵۴ | زنون (Xe) | از واژه Xenos به معنای عجیب و غریب گرفته شده است. |
| ۵۵ | سزیم (Cs) | از واژه Coesius به معنای آبی آسمانی گرفته شده است. |
| ۵۶ | باریم (Ba) | از واژه Barys به معنای سنگین گرفته شده است. |
| ۵۷ | لانتان (La) | به معنی دروغ گفتن. |
| ۵۸ | سریم (Ce) | به معنی نان و غلات. |
| ۵۹ | پرازئودیمیم (Pr) | به معنی سبز دوقلو. |
| ۶۰ | نئودیمیم (Nd) | به معنی دوقلوی جدید. |
| ۶۱ | پرومتیم (Pm) | به معنی پیش بینی و دوراندیشی. |
| ۶۲ | ساماریم (Sm) | – |
| ۶۳ | یوروپیم (Eu) | از واژه اروپا گرفته شده است. |
| ۶۴ | گادولینیم (Gd) | به افتخار Johan Gadolin (شیمیدان) نامگذاری شده است. |
| ۶۵ | تربیم (Tb) | از واژه Ytterby (دهکده ای در سوئد) گرفته شده است. |
| ۶۶ | دیسپروزیم (Dy) | از واژه یونانی dysprositos به معنی “دشوار است”. |
| ۶۷ | هولمیم (Ho) | از واژه لاتین Holmia به معنی استکهلم گرفته شده است. |
| ۶۸ | اربیم (Er) | از واژه Ytterby (دهکده ای در سوئد) گرفته شده است. |
| ۶۹ | تولیم (Tm) | از واژه یونانی Thule که یک کشور افسانه ای است گرفته شده است. |
| ۷۰ | ایتربیم (Yb) | از واژه Ytterby (دهکده ای در سوئد) گرفته شده است. |
| ۷۱ | لوتتیم (Lu) | به معنی پاریس. |
| ۷۲ | هافنیم (Hf) | به معنی کپنهاگ. |
| ۷۳ | تانتال (Ta) | به معنی حمل کننده. |
| ۷۴ | تنگستن (W) | به معنی سنگ سنگین. |
| ۷۵ | رنیوم (Re) | از نام رودخانه ی راین گرفته شده است. |
| ۷۶ | اسمیم (Os) | از واژه یونانی osme به معنی “یک بو”. |
| ۷۷ | ایریدیم (Ir) | به معنی “از رنگین کمان”. |
| ۷۸ | پلاتین (Pt) | – |
| ۷۹ | طلا (Au) | – |
| ۸۰ | جیوه (Hg) | – |
| ۸۱ | تالیم (Tl) | از واژه Thallos به معنای شاخه سبز گرفته شده است. |
| ۸۲ | سرب (Pb) | از واژه Lead که اصطلاحی آنگلوساکسون است، گرفته شده است. |
| ۸۳ | بیسموت (Bi) | از واژه Bisemutum که نام آلمانی عنصر است گرفته شده است. |
| ۸۴ | پولونیم (Po) | از واژه Poland که نام کشور لهستان زادگاه ماری کوری است گرفته شده است. |
| ۸۵ | استاتین (At) | از واژه Astatos به معنای ناپایدار گرفته شده است. |
| ۸۶ | رادون (Rn) | تلفیق دیگری از نام عنصر رادیم است. |
| ۸۷ | فرانسیم (Fr) | از واژه France از واژه فرانسه که این عنصر در آنجا کشف شده است، گرفته شده است. |
| ۸۸ | رادیم (Ra) | از واژه Radius به معنای اشعه گرفته شده است. |
| ۸۹ | اکتینیم (Ac) | – |
| ۹۰ | توریم (Th) | – |
| ۹۱ | پروتاکتینیم (Pa) | – |
| ۹۲ | اورانیوم (U) | از نام سیاره ی اورانوس گرفته شده است. |
| ۹۳ | نپتونیوم (Np) | از نام سیاره ی نپتون گرفته شده است. |
| ۹۴ | پلوتونیم (Pu) | به معنی خدای ثروت. |
| ۹۵ | امریسیم (Am) | به افتخار کشور آمریکا. |
| ۹۶ | کوریم (Cm) | به افتخار پیر کوری و ماری کوری. |
| ۹۷ | برکلیم (Bk) | به افتخار دانشگاه برکلی کالیفرنیا. |
| ۹۸ | کالیفرنیم (Cf) | از کلمه کالیفرنیا، به افتخار دانشگاه برکلی کالیفرنیا. |
| ۹۹ | اینشتینیم (Es) | به افتخار آلبرت اینشتین. |
| ۱۰۰ | فرمیم (Fm) | به افتخار انریکو فرمی. |
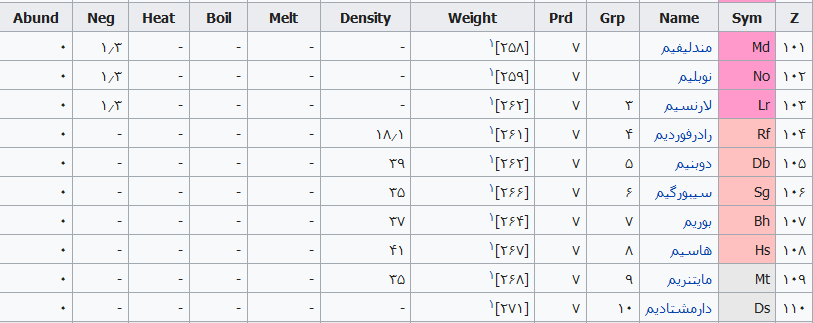
| ۱۰۱ | مندلیفیم (Md) | – |
| ۱۰۲ | نوبلیم (No) | – |
| ۱۰۳ | لارنسیم (Lr) | – |
| ۱۰۴ | رادرفوردیم (Rf) | – |
| ۱۰۵ | دوبنیم (Db) | – |
| ۱۰۶ | سیبورگیم (Sg) | – |
| ۱۰۷ | بوریم (Bh) | – |
| ۱۰۸ | هاسیم (Hs) | – |
| ۱۰۹ | مایتنریم (Mt) | – |
| ۱۱۰ | دارمشتادیم (Ds) | – |
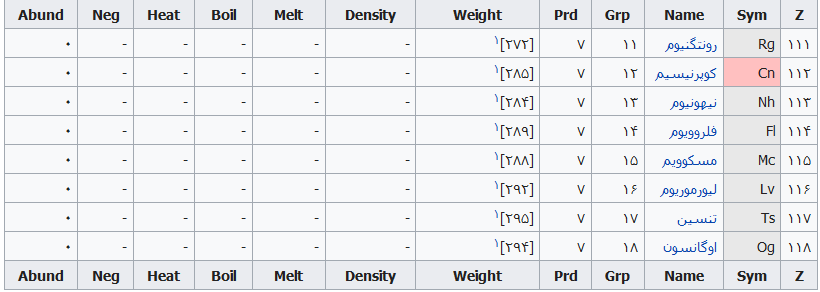
| ۱۱۱ | رونتگنیوم (Rg) | – |
| ۱۱۲ | کوپرنیسیم (Cn) | – |
| ۱۱۳ | نیهونیوم (Nh) | به معنی ژاپن. |
| ۱۱۴ | فلروویوم (Fl) | – |
| ۱۱۵ | مسکوویم (Mc) | – |
| ۱۱۶ | لیورموریوم (Lv) | به افتخار آزمایشگاه Lawrence Livermore National Laboratory. |
| ۱۱۷ | تنسین (Ts) | – |
| ۱۱۸ | اوگانسون (Og) | به افتخار Yuri Oganessian (شیمیدان). |

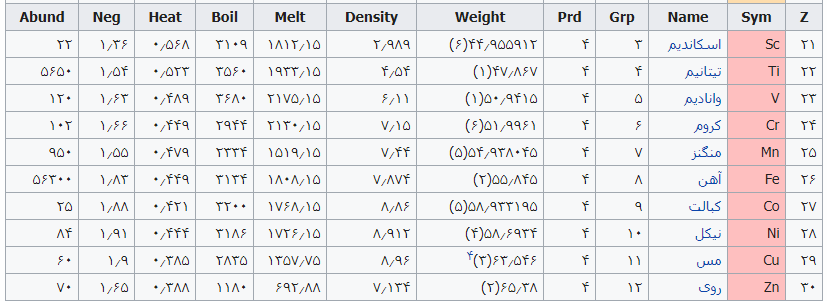
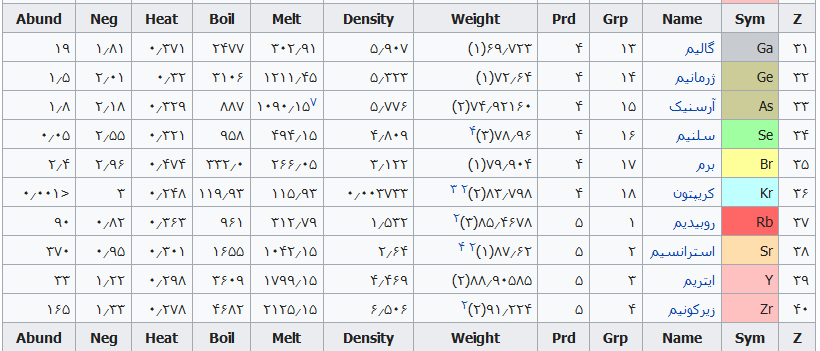
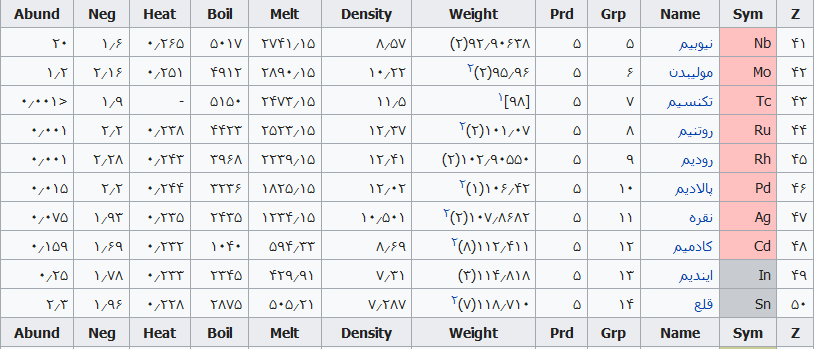
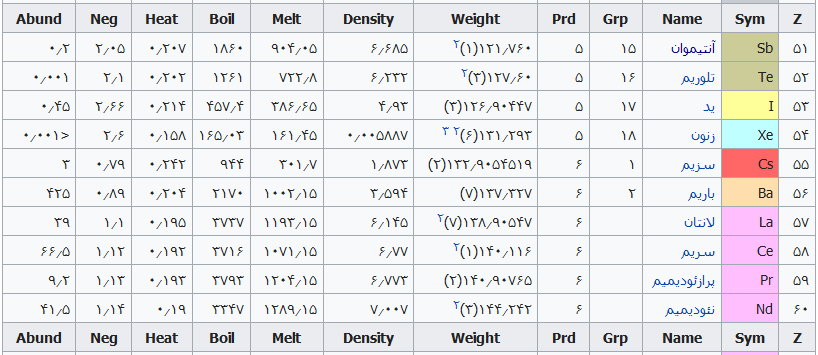
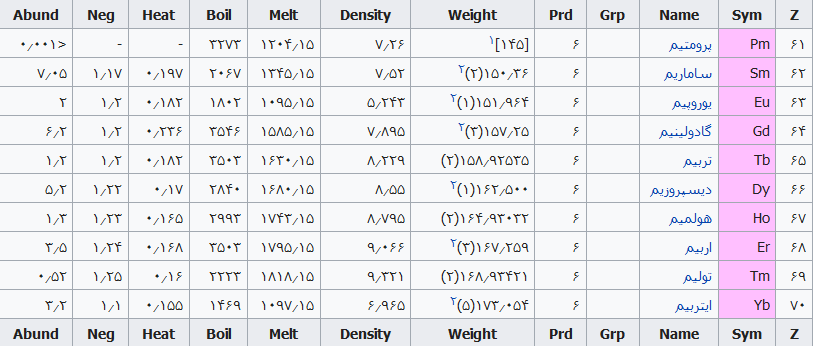
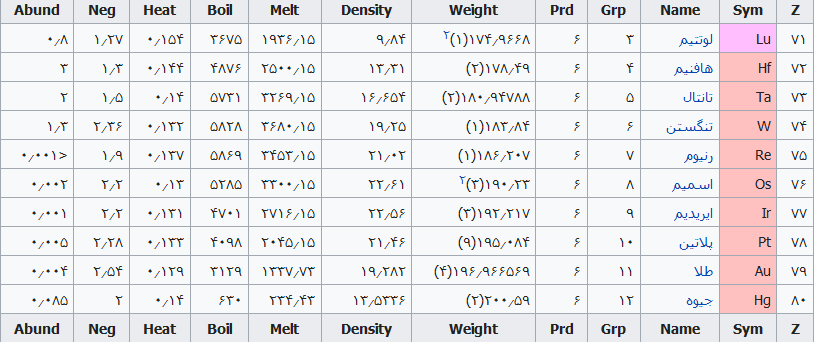
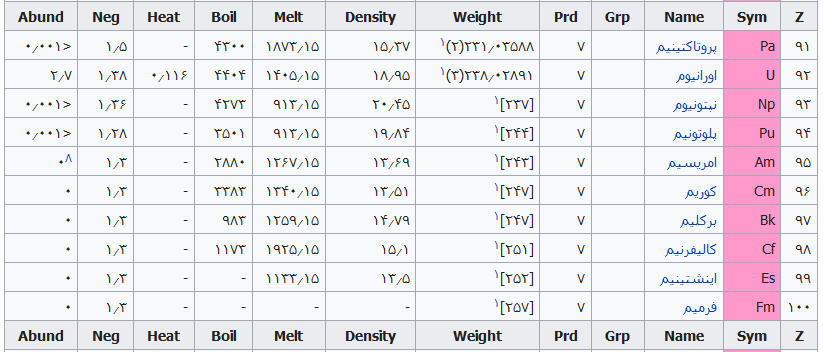
جدول تهیه شده ذیل برای:
مشخص کردن عناصر شیمیایی بر اساس عدد اتمی استو رنگها بر اساس نوع عنصر طبقهبندی شدهاند.
در این جدول همچنین شماره گروه و دوره، جرم اتمی، چگالی، ایزوتوپ، فراوانی، الکترونگاتیویته، دمای جوش و دمای ذوب آورده شدهاست. این فهرست به جهت دستیابی جزئی و سریع برای عناصر محسوب میگردد؛ که با مطالعه فهرست وار و توجه به رنگها و ردیف جدول اطلاعات قابل توجهی را نسیب خواهید کرد ..
همچنین باید گفت این نحوه اشنایی باعث بخاطر ماندن نام وقابلیتهای جدول تناوبی میباشد و اینکه قدرت تفکر شیمیایی استاد مندلیف را بیشتر درک خواهید کرد .
فهرست عناصر جدول تناوبی
راهنمای عنوان ستونها
Z == عدد اتمی،
Sym == نشان شیمیایی،
Name ==نام عنصر،
Grp == گروههای جدول تناوبی،
Prd == دوره (شیمی)
Weight == جرم اتمی،
Density == چگالی (گرم بر سانتیمتر مربع(
Melt ==دمای ذوب با واحد کلوین،
Boil == نقطه جوش با واحد کلوین
Heat == ظرفیت گرمایی با واحد (ژول بر گرم کلوین)
Neg == الکترونگاتیوی
Abund == فراوانی عنصر در زمین با واحد ppm وزنی است.
چهار عنصر جدید در جدول تناوبی مندلیف به تازگی نامهای خود را دریافت کردهاند که تعداد کل عناصر شناخته شده را به ۱۱۸ رساندهاند.
به گزارش سرویس علمی ایسنا به نقل از بیبیسی، هیچ کدام از این عناصر در طبیعت تولید نشده و محصول تجربیات حوزه فیزیک هستند.
اتحادیه بینالمللی شیمی خالص و کاربردی که نهاد حاکم بر تحقیقات شیمیایی است، این خبر را اعلام کرده است.
عناصر شیمی بر اساس تعداد پروتون دارای بار مثبت درون هستهشان شمارهگذاری میشوند.
“نیهونیوم” عنصر شماره ۱۱۳، “موسکوویوم” عنصر شماره ۱۱۵ و دارای ۱۱۵ پروتون، “تنسین” عنصر شماره ۱۱۷ و “اوگانسون” در جایگاه شماره ۱۱۸ جدول تناوبی هستند.
نامگذاری عناصر در حال حاضر ممکن است از روی نام یک دانشمند، منطقه، ماده معدنی، مفهوم اساطیری یا خواص ماده انجام شود.
اتحادیه بینالمللی شیمی خالص و کاربردی در بیانیهای اعلام کرد: زمانیکه نامی برای یک عنصر خاص استفاده شده اما در نهایت یک نام دیگر برای آن انتخاب میشود، دیگر نمیتوان نام اول را برای عنصر دیگر بکار برد. نام تمام عناصر بطور کلی از یک پایان برخوردار است که انعکاسدهنده و حافظ قوام تاریخی و شیمیایی آنهاست.
نیهونیوم نخستین عنصری است که توسط محققان آسیای شرقی نامگذاری شده و برای اولین بار، اسم آن از روی اقوام حاضر در یک منطقه انتخاب شده است. نیهون یکی از نامهای ژاپنی است. البته ابتدا نام ژاپنیوم قرار بود برای این عنصر که در سال ۲۰۰۴ کشف شده، انتخاب شود.
عنصر شماره ۱۱۵ یعنی موسکوویوم به افتخار منطقه مسکو که موسسه مشترک تحقیقات فیزیکی در آن قرار داد، نامگذاری شد.
تنسین که از ۱۱۷ پروتون برخوردار است، نام خود را به افتخار ایالت تنسی دریافت کرده که به فیزیک مرتبط است. تنسی همانند مسکو، میزبان مراکز تحقیقاتی عناصر سنگین از جمله آزمایشگاه ملی اوک ریج، دانشگاه تنسی و دانشگاه واندربیلت است.
اوگانسون نیز نام خود را از یوری اوگانسیان، محقق ۸۳ ساله موسسه مشترک تحقیقات اتمی روسیه گرفته که در کشف چندین عنصر سنگین کمک کرده است. ا
البته اوگانسون تنها دانشمندی نیست که نامش در جدول تناوبی امده ..اما تنها دانمشند زنده ایست که اخرین عنصر جدول تناوبی را به نام خود رقم زده ,,
نکته مهم این است که ایین دانشمند نقش بسزایی در تکمیل جدول تناوبی دارد بطوریکه از عنطر ۱۰۱ تا ۱۱۸ را مدیون زحمات ایشان وتیم تحقیقی اوگانسون میدانند .
در ذیل تلاش کردم اشنایی مختصری با این دانشمند را با خامه در دست رقم بزنم .

تصویر پروفسور یوری اوگانسیان، محقق و تحلیلگر شیمی وفیزیک در هنگام تدریس در پایگاه اتمی روسیه امروزی .
آشنایی با آقای عنصر ۱۱۸ جدول تناوبی
پروفسور یوری اوگانسیان (Yuri Oganessian)، فیزیکدان روس که عنصر ۱۱۸ از روی نام وی انتخاب شده است، تنها فرد زنده در جدول تناوبی عناصر شیمیایی است.
عنصر اوگانسون با عدد ۱۱۸ و نماد شیمیایی Og، نام خود را از دانشمند و محقق ۸۴ ساله امروزی موسسه مشترک تحقیقات اتمی (JINR) روسیه گرفته است. تحقیقات این دانشمند و تیم تحقیقاتی وی، منجر به کشف این عنصر شد.
تنها دانشمند زنده در جدول تناوبی، در مصاحبه با نیو ساینتیست، به سوالاتی درخصوص خودش وهمچنین کشف این عنصر((Og (( وهمچنین دیگر عناصر ,پاسخ می دهد.
شما تنها دانشمند زنده ای هستید که یک عنصر از روی نام وی، نامگذاری شده است. چه احساسی از قرار گرفتن نامتان در کنار نام هایی همچون آلبرت اینشتین و ماری کوری دارید؟
این یک افتخار برای من محسوب می شود. کشف عنصر ۱۱۸ جدول تناوبی نتیجه تلاش محققان موسسه مشترک تحقیقات اتمی (JINR) روسیه و آزمایشگاه ملی لاورنس لیورمول در آمریکا بود. همکاران من نام اوگانسون را برای این عنصر پیشنهاد کردند.
از سال ۱۹۵۶ تاکنون، به کشف چند عنصر در جدول تناوبی کمک کرده اید؟
زمانی که تحقیقات خود را آغاز کردم، تنها ۱۰۱ عنصر شناسایی شده بودند؛ اما اکنون تعداد این عناصر به ۱۱۸ رسیده است و هفتمین ردیف جدول تناوبی کامل شده است. زمانی که به آزمایشگاه فلروف (Flerov) ملحق شدم، بر روی متنوعی کار کردم و در تحقیقات منجر به کشف آنها مشارکت قوی داشتم.نام ,مشخصات و مختضری از زندگی 15 تن ازدانشمندانی که تا قبل از اوگالسون نامشان در اسامی عناصر شیمیایی جدول تناوبی به کار رفتهاست وبرای جهان علم زحمات ومشقتهای بسیار زیادی را متحمل شده اند به شرح ذیل ملاحظه میفرمایید
| نام دانشمند | تاریخ تولد و مرگ | Element’s Discovery Date | ملیت | نام عنصر | سمبل | عدد اتمی. |
| یوهان گادولین | ۱۷۶۰–۱۸۵۲ | ۱۸۸۶ | فنلاندی | گادولینیم | Gd | ۶۴ |
| ماری کوری پیر کوری | ۱۸۶۷–۱۹۳۴ ۱۸۵۹–۱۹۰۶ | ۱۹۴۴ | لهستانی–فرانسوی French | کوریم | Cm | ۹۶ |
| آلبرت اینشتین | ۱۸۷۹–۱۹۵۵ | ۱۹۵۲ | آلمانی–آمریکایی | اینشتینیم | Es | ۹۹ |
| انریکو فرمی | ۱۹۰۱–۱۹۵۴ | ۱۹۵۲ | ایتالیایی-آمریکایی | فرمیم | Fm | ۱۰۰ |
| دمیتری مندلیف | ۱۸۳۴–۱۹۰۷ | ۱۹۵۵ | روسی | مندلیفیم | Md | ۱۰۱ |
| آلفرد نوبل | ۱۸۳۳–۱۸۹۶ | ۱۹۵۷ | سوئدی | نوبلیم | No | ۱۰۲ |
| ارنست لارنس | ۱۹۰۱–۱۹۵۸ | ۱۹۵۷ | آمریکایی | لارنسیم | Lr | ۱۰۳ |
| ارنست رادرفورد | ۱۸۷۱–۱۹۳۷ | ۱۹۶۴ | New Zealand–بریتانیایی | رادرفوردیم | Rf | ۱۰۴ |
| گلن سیبورگ | ۱۹۱۲–۱۹۹۹ | ۱۹۷۴ | آمریکایی | سیبورگیم | Sg | ۱۰۶ |
| نیلز بور | ۱۸۸۵–۱۹۶۲ | ۱۹۸۱ | دانمارکی | بوریم | Bh | ۱۰۷ |
| لیزه مایتنر | ۱۸۷۸–۱۹۶۸ | ۱۹۸۲ | Austrian-سوئدی | مایتنریم | Mt | ۱۰۹ |
| ویلهلم رونتگن | ۱۸۴۵–۱۹۲۳ | ۱۹۹۴ | آلمانی | رونتگنیوم | Rg | ۱۱۱ |
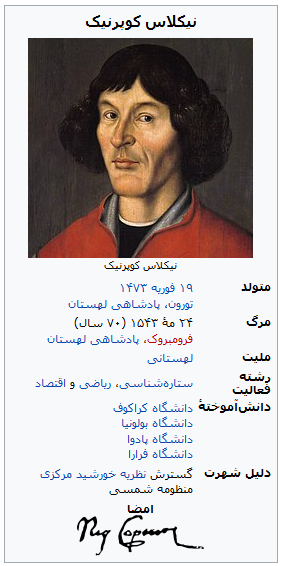
| نیکلاس کوپرنیک | ۱۴۷۳–۱۵۴۳ | ۱۹۹۶ | لهستانی-آلمانی | کوپرنیسیم | Cn | ۱۱۲ |
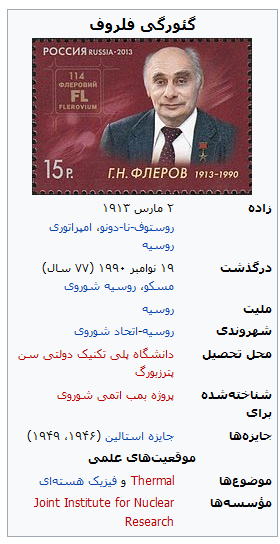
| گئورگی فلیرف | ۱۹۱۳–۱۹۹۰ | ۱۹۹۸ | روسی | فلروویوم | Fl | ۱۱۴ |
یوهان گادولین”
یوهان گادولین (انگلیسی: Johan Gadolin؛ زاده ۵ ژوئن ۱۷۶۰ درگذشته ۱۵ اوت ۱۸۵۲) یک دانشمند در زمینه شیمی اهل سوئد / فنلاند بود.
عدد ۶۴ جدول تناوبی با انام اختصاری Gdاتمی جدول تناوبی به نام این دانشمند ثبت شده است .
ماری کوری”
ماریا اسکلودوسکا کوری (به لهستانی: Marie Salomea Skłodowska-Curie) شناخته شده با نام ماری کوری (زاده ۷ نوامبر ۱۸۶۷ – درگذشته ۵ ژوئیه ۱۹۳۴) فیزیکدان و شیمیدان لهستانی-فرانسوی بود.
وی در ۷ نوامبر ۱۸۶۷ در ورشو پایتخت لهستان متولد شد. در ۱۸۹۳ لیسانس خود را در رشته فیزیک دریافت کرد و تنها یک سال بعد در رشته ریاضیات نیز موفق به اخذ لیسانس گردید. ماری کوری نخستین زنی است که برنده جایزه نوبل شد. او همچنین اولین دانشمند و تنها زنی است که دو بار جایزهٔ علمی نوبل دریافت کردهاست و تنها فردی است که دو جایزه نوبل را در دو رشته مختلف کسب کردهاست. او ابتدا این جایزه را در رشتهٔ فیزیک در ۱۹۰۳ و سپس در رشته شیمی در ۱۹۱۱ دریافت کرد.[۳]
موفقیتهای وی شامل نظریه رادیواکتیویته (اصطلاحی که خودش ابداع و باب کرد[۴])، روشهایی برای جداسازی ایزوتوپ و کشف دو عنصر، پولونیم و رادیوم است. به تاسی از کارهای وی اولین مطالعات پرتوزایی روی از بین بردن تومورها از طریق ایزوتوپهای رادیواکتیو صورت گرفت. وی دو مرکز کوری یکی در پاریس و دیگری در ورشو راهاندازی کرد که امروز از مراکز بزرگ پزشکی هستند ولی همچنین در جنگ جهانی اول اولین مرکز درمانی نظامی رادیو پزشکی را ایجاد کرد.
وی اگرچه شهروند فرانسه بود ولی از امضای ماریا اسکلودوسکا کوری استفاده میکرد.[۵][۶] و هیچگاه هویت ملی خویش را فراموش نکرد. وی به دخترانش زبان لهستانی یاد داد و آنها را برای بازدید به لهستان میبرد.[۷] همچنین اولین عنصری که کشف کرد را به افتخار لهستان، پولونیوم نامید.
کوری در ۱۹۳۴ به خاطر کمخونی آپلاستیک که ناشی از پرتوزایی پرتو ایکس بود درگذشت. وی این پرتوها را به خاطر تحقیقاتش در مراکز پزشکی نظامی در جنگ جهانی اول دریافت کرده بود.[۸]
او دربارهٔ مذهب خود و همسرش میگوید «پیر به هیچ دین و مذهبی تعلق نداشت و من نیز هیچ دین و مذهبی را تجربه نکردم»
پیر کوری”
پیر کوری (به فرانسوی: Pierre Curie) (متولد ۱۵ مه ۱۸۵۹-درگذشته ۱۹ آوریل ۱۹۰۶)، فیزیکدان فرانسوی بود و از پیشگامان عرصه بلورشناسی، مغناطیس و رادیو اکتیویته بود.
او و همسرش ماری کوری، به همراه آنری بکرل در سال ۱۹۰۳ موفق به دریافت جایزه فیزیک نوبل گردیدند. آنها این جایزه را به خاطر کشف خودپرتوزایی و مطالعه پدیدههای تابشی در در کشف رونتگن، دریافت نمودند.
پیر کوری، مدتها مشغول تحقیق در ارتباط با خواص فیزیکی عناصر جدید بود. آنها پس از مدتها کار مدام، توانستند در سال ۱۹۰۲ از چند تن کانی پیچبلند، تنها یک دهم گرم کلرید رادیوم خالص را جدا کنند و در نتیجه این تحقیقات، او و همکارانش توانستند جایزه نوبل را دریافت کنند.
پیر کوری در سال ۱۹۰۶ در سن ۴۷ سالگی در اثر برخورد با یک درشکه درگذشت.
آلبرت اَینشتَین”
آلبرت اَینشتَین (به آلمانی: Albert Einstein) (به آلمانی آینشتاین و انگلیسی آینستاین[۷]) (زاده ۱۴ مارس ۱۸۷۹ – درگذشته ۱۸ آوریل ۱۹۵۵) فیزیکدان نظری یهودی الاصل آلمانی بود. او بیشتر، به خاطر نظریّه نسبیت و به ویژه برای همارزی جرم و انرژی (E=mc۲ که از آشناترین رابطهها در فیزیک بین غیرفیزیکدانهاست) شهرت دارد. علاوه بر این، او در بسط تئوری کوانتوم و مکانیک آماری سهم عمدهای داشت. اینشتین جایزه نوبل فیزیک را در سال ۱۹۲۱ برای خدماتش به فیزیک نظری و به خصوص به خاطر کشف قانون اثر فوتوالکتریک دریافت کرد. او به دلیل تأثیرات چشمگیرش، به عنوان یکی از بزرگترین فیزیک دانانی شناخته میشود که به این جهان پا گذاشتهاند.

انریکو فرمی”
انریکو فرمی (“به ایتالیایی: Enrico Fermi) (زاده ۲۹ سپتامبر ۱۹۰۱ در رم، ایتالیا؛ درگذشته ۲۸ نوامبر ۱۹۵۴ در شیکاگو، ایلینوی، ایالات متحده)، فیزیکدان آمریکایی ایتالیایی الاصل است. او شهرتش را بیشتر مدیون زحمتهایش در موضوع واپاشی بتا، طراحی اولین رآکتور هستهای و همچنین گسترش نظریه کوانتومی میباشد. فرمی سال ۱۹۳۸ موفق به دریافت جایزه نوبل فیزیک شد که در رابطه با کارهایش در مورد رادیواکتیوی انجام داده بود. وی یکی از بزرگترین فیزیکدانان هستهای قرن بیستم بهشمار میرود.
او در هفده سالگی به تحصیل فیزیک در دانشگاه پیزا پرداخت، که آن را با مقطع دکترا در مورد پراکندگی اشعه ایکس سال ۱۹۲۲ به پایان رسانید.
بین سالهای ۱۹۳۰–۱۹۴۰ همراه با برونو پونتهکورو، در تحقیقات در مورد نوترینوها شرکت داشت.
فرمی تابستان ۱۹۴۴ به همراه خانوادهاش به لاس آلاموس در نیومکزیکو رفت و به عنوان مشاور روبرت اوپنهایمر نقش به سزایی در ساخت و اختراع بمب اتمی داشت. وی تا روزهای آخر عمر خود در ایلینوی سکونت داشت و کرسی استادی دانشگاه شیکاگو را نیز بر عهده داشت.
بعد از دریافت جایزه نوبل سال ۱۹۳۸، او همچنین موفق به کسب مدال ماکس پلانک در سال ۱۹۵۴ شد.
به نام فرمی، گاز فرمی (گازهای الکترونی)، فرمیونها (گروهی از ذرات بنیادی) و همچنین عنصر شیمیایی فرمیوم اسمگذاری شده است. کمیسیون انرژی اتمی آمریکا به یادبود این دانشمند بزرگ، جایزه انریکو فرمی را به ارزش ۳۷۵٬۰۰۰ دلار پایهگذاری کرده، که هر ساله اعطا میشود.

دمیتری ایوانویچ مِندِلیف”
در مقدمه علم متالورژی به طور مفصل ومبسوط راجع به این دانشمند صحبت کردیم
دمیتری ایوانویچ مِندِلیف (به روسی: Дмитрий Иванович Менделеев)، شیمیدان معروف اهل روسیه است. وی پایهگذار جدول تناوبی عناصر شیمیائی موسوم به «جدول مندلیف» است، او بوسیلهٔ این جدول توانست وجود تعداد زیادی از عنصرهای کشف نشده را پیشبینی نماید. وی ترتیب قرار گرفتن عنصرها را در جدول بر پایهٔ افزایش تدریجی جرم اتمی آنها در یک ردیف (تناوب) قرار داد تا به این وسیله خواص شیمیایی عناصر به صورت گروهی عمودی تکرار شود.

آلفرد برنهارد نوبل”
آلفرد برنهارد نوبل (به سوئدی: Alfred Bernhard Nobel) (زادهٔ ۲۱ اکتبر ۱۸۳۳ در استکهلم، سوئد – درگذشتهٔ ۱۰ دسامبر ۱۸۹۶ در سانرمو، ایتالیا) شیمیدان، مهندس، مبتکر و اسلحهساز سوئدی است که به عنوان مخترع دینامیت شناخته میشود. او از سال ۱۸۹۴ تا روز مرگش صاحب اسلحهسازی بزرگ بوفورس بود و در تغییر آن از یک کارخانه ذوب آهن به یک توپخانهسازی مدرن و یک کارخانه تولید مواد شیمیایی نقشی اساسی داشت. وی در آخرین وصیتنامه خود سرمایه حیرت انگیزش را برای تأمین هزینههای جایزهٔ نوبل اختصاص داد. عنصر شیمیایی نوبلیم به احترام او نامگذاری شدهاست.
ارنست ارلاندو لارنس “
ارنست ارلاندو لارنس (به انگلیسی: Ernest Orlando Lawrence) (متولد ۸ اوت ۱۹۰۱ در کانتون، داکوتای جنوبی – درگذشتهٔ ۲۷ اوت ۱۹۵۸)، یک فیزیکدان و برنده جایزه نوبل آمریکایی بود.
او این جایزه را به خاطر اختراع و ساخت سیکلوترون دریافت کرد.[۱]
او در سال ۱۹۲۵ از از دانشگاه ییل با درجه دکترا فارغالتحصیل شد.

ارنست رادرفورد
ارنست رادرفورد (به انگلیسی: Ernest Rutherford, 1st Baron Rutherford of Nelson) فیزیکدان هستهای اهل نیوزلند بود که نامبخش عنصر رادرفوردیم نیز بود.
او در تاریخ ۳۰ اوت سال ۱۸۷۱ در حومه برایتواتر شهر نلسون واقع ساحل شمالی جزیره جنوبی نیوزلند متولد شد. او چهارمین فرزند از دوازده فرزند جیمز و مارتا رادرفورد نیوزیلندیهای نسل اول بود که از کودکی از اسکاتلند به زلاند نو آورده شده بودند. خانواده رادرفورد یک خانواده پر جمعیت دوازده بچهای بود که اعضای آن همه در انجام کارهای روزمره خانواده مشارکت میکردند اهل خانه همه افرادی جدی و کلیسا رو، خوشحال و با فرهنگ بودند. علاقهمندی رادرفورد به علوم در مرحله زودی بروز کرد. او ده ساله بود که کتاب پرطرفداری به نام خواندنیهای اولیه در فیزیک تألیف معلمی بنام بالفور استوارت به دست آورد. کتاب استوارت مشابه کتابهای خود آموز فیزیک آموزی بود که در آنها نحوه به نمایش درآوردن اصول پایه فیزیک یا استفاده از اشیای ساده موجود در خانه مانند سکه، شمع، سنگ وزنه و وسایل آشپزخانه به خواننده یاد داده میشود. رادرفورد جوان سخت شیفته آن کتاب شده بود نخستین بورسیه از بورسیههای تحصیلی متعدد زندگی خود را در سال ۱۸۸۷ که ۱۶ ساله بود به دست آورد.
تحصیل در دانشگاه
بورس تحصیلی دومی وی را قادر به ثبت نام در دانشکده کنتربوری شهر کرایستچرچ کرد که مؤسسهای بود که در سال پیش از تولد خود او به وجود آمده بود. وی رشتههای تحصیلی اصلی خود را فیزیک و ریاضیات انتخاب کرد که از بخت مساعد در هر دوی آنها معلمان خوبی هم داشت. رادرفورد در پایان دوره آموزشی سه ساله خود درجه کارشناسی ریاضی و فیزیک – ریاضی و (بطور کلی) علوم فیزیکی به پایان رسانید. نکته قابل ذکر در رابطه با زندگی خصوصی وی در ایام اقامت در کریستچرچ اینکه وی در آنجا با ماری نیوتن دختر صاحبخانه خود آشنا و پایبند عشق او شد. رادرفورد در پی انتشار دو مقاله مهم دربارهٔ فعالیت تشعشعی مواد در سال ۱۸۹۵ بر خلاف دوم شدن در گزینش، جایزه مهمی به شکل یک بورس تحصیلی دریافت کرد مقررات اعطای جایزه حق انتخاب مؤسسه آموزشی را به خود برنده جایزه میداد که رادرفورد آزمایشگاه کاوندیش دانشگاه کمبریج به مدیریت جی. جی تامسون (صاحب نظر پیشتاز جهان در زمینه الکترومغناطیس) را برگزید در آن سال ویلهلم رونتگن فیزیکدان آلمانی موفق به کشف اشعه ایکس ک در پی آن کشف خاصیت پرتوزایی توسط هانری بکرل و نامگذاری این خاصیت توسط ماری کوری انجام گردید. کشف مهم دیگری که منجر به شروع کار اصلی رادرفورد شد.
کارهای علمی
رادرفورد در سال ۱۸۹۵ به آزمایشگاه کاوندیش دانشگاه کمبریج آمد تا در آنجا تحت مدیریت جی.جی تامسون مشغول به کار شود. تامسون که استاد فیزیک تجربی بود، رادرفورد را فعالانه در آزمایشگاه به کار گرفت. رادرفورد در اوایل کار تحقیقاتی خود با انجام آزمایشی که فکر آن از خود وی بود دو تابش رادیواکتیوی ناهمانند شناسایی کرد او پی برد که بخشی از تابش با برگهای به ضخامت یک پانصدم سانتیمتر قابل ایستادن بود اما برای متوقف کردن بخش دیگر برگههای بس ضخیمتری لازم بود. او اولین اشعهای را که تابشی با بار الکتریکی مثبت و یونیده کنندهای قوی بود و به سهولت در مواد جذب میشد اشعه آلفا نامید. اشعه دوم را که تابشی بار الکتریکی منفی بود و تشعشع کمتری ایجاد میکرد اما قابلیت نفوذ آن در مواد زیاد بود اشعه بتا نامید. تابش نوع سومی که شبیه پرتوهای ایکس بود در سال ۱۹۰۰ بهوسیله پل اوریچ ویلارد (فیزیکدان فرانسوی) کشف شد این پرتو نافذترین تابش را داشت. طول موج آن بسیار کوتاه و بسامد آن فوقالعاده زیاد بود. تابش جدید، پرتو گاما نام گرفت. رادرفورد و همکارانش کشف کردند که فعالیت تشعشعی طبیعی مشهود در اورانیوم: فرایند خروج ذره آلفا از هسته اتم اورانیوم به صورت یک هسته اتم هلیم و بر جای ماندن اتمی سبکتر از اتم اورانیوم در اورانیوم به ازاء هر خروج ذره آلفا از آن است از کشف آنها نتیجهگیری شد که رادیوم تنها عنصر از شرته عناصر حاصل از فعالیت تشعشعی اورانیوم است.
رادرفورد در سال ۱۹۰۳ به عضویت انجمن سلطنتی لندن درآمد و در سال ۱۹۰۴ نخستین کتاب خود به نام فعالیت تشعشعی را که امروزه از کتب کلاسیک نوشته شده در آن زمینه شناخته میشود، منتشر کرد شهرت رو به افزون رادرفورد در جوامع علمی سبب شد که از طرف دانشگاهها تصدی کرسیهای زیادی به وی پیشنهاد شود. او در سال ۱۹۰۷ به انگلستان بازگشت تا تصدی مقام مذکور را در دانشگاه منچستر به عهده بگیرد رادرفورد در دانشگاه منچستر رهبر گروهی شد که به سرعت دست به کار تدوین نظریههای تازه دربارهٔ ساختار اتم شد. آن دوره پر ثمرترین دوره زندگی دانشگاهی او بود. رادرفورد به پاس کوششهای علمی خود در دانشگاه منچستر نشانها و جوایز زیادی دریافت کرد که دریافت جایزه نوبل شیمی در سال ۱۹۰۷ نقطه اوج آن بود. این نشان افتخار را البته برای کارهایی که در کانادا در زمینه فعالیت تشعشعی عناصر کرده بود به او دادند. بزرگترین دستاورد رادرفورد در دانشگاه منچستر کشف ساختار هسته اتم بود. پیش از رادرفورد اتم به گفته خود او یک موجود نازنین سخت و قرمز یا به حسب سلیقه خاکستری بود اما اینک یک منظومه شمسی بسیار ریز متشکل از ذرات بی شمار بود که مظنون به نهفته داشتن اسرار ناگشوده متعدد دیگر در سینه هم بود.
مرگرادرفورد در سال ۱۹۳۷ در اثر یک فتق محتقن (گونهای تورم ناشی از انسداد اعضای درونی) که به خاطر سقوط وی از درخت در هنگام هرس کردن آن اتفاق افتاد، در گذشت. او در آن هنگام ۶۶ ساله و هنوز سرزنده و قوی بود. سهم رادرفورد در شکلگیری درک کنونی ما از ماهیت ماده از هر کس دیگری بیشتر است. او آشکارا بزرگترین فیزیکدان آزمایشگری بود که تا آن زمان جهان به خود دیده بود. دهها انجمن علمی و دانشگاه به او عضویت و درجات دانشگاهی افتخاری دادهاند و او را پدر انرژی هستهای نامیدهاند
گلن تئودور سیبورگ”گلن تئودور سیبورگ (انگلیسی Glenn Theodore Seaborg) شیمیدان هستهای آمریکایی بود که در سال ۱۹۵۱ به علت همکاری در کشف ده عنصر فرااورانیمی، برنده جایزه نوبل شیمی شد.[۱] وی برای نخستین بار مفهوم آکتینیدها را ارائه کرد و عنصرهای ۹۰ (توریم) تا ۱۰۳ (لورنسیم) جدول تناوبی را “اکتینیدها” نامید و آنها را در ردیفی جداگانه زیر لانتانیدها طبقهبندی کرد. سیبورگ برای نخستین بار اصطلاح جزیرهٔ پایداری را در فیزیک هستهای ابداع کرد. اکثر فعالیتهای علمی وی در دانشگاه کالیفرنیا در برکلی انجام شد.[۲] عنصر ۱۰۶ جدول تناوبی به افتخار وی سیبورگیوم نامگذاری شد. او در این باره گفت: “این بزرگترین افتخاری است که تاکنون به من داده شدهاست. حتی فکر میکنم بزرگتر از جایزهٔ نوبل
نیلز بور”
نیلز هنریک داوید بور[۲] (به دانمارکی: Niels Henrik David Bohr) (۷ اکتبر ۱۸۸۵ – ۱۸ نوامبر ۱۹۶۲،[۳] کپنهاگ، دانمارک) فیزیکدان دانمارکی بود که شهرت او بیشتر به علت ردکردن مدل اتمی ارنست رادرفورد و ابداع مدل اتمی خود است. او تلاشهایی بنیادی در زمینهٔ شناخت ساختار اتم و مکانیک کوانتوم داشت و برای همین تلاشهایش در سال ۱۹۲۲، به او جایزهٔ نوبل فیزیک داده شد. او مدل پیشنهادی اتم که مانند سامانهٔ خورشیدی بود (یک هسته در مرکز و الکترونها پیرامونش در گردش) را گسترش داد، او بر روی نظریهاش در بستر مکانیک کوانتوم کار کرد و گفت که الکترون از یک تراز انرژی به صورت کمیتی گسسته و نه پیوسته، به یک تراز دیگر انرژی میپرد. بور با بسیاری از فیزیکدانان نامی در مؤسسهاش در کپنهاگ همکاری کرد. همچنین او عضو گروه فیزیکدانان بریتانیایی پروژهٔ منهتن بود. بور در سال ۱۹۱۲ ازدواج کرد و صاحب چند فرزند شد که یکی از پسرانش، آگه بوهر فیزیکدان بود و توانست در سال ۱۹۷۵ مانند پدرش، جایزهٔ نوبل را از آن خود کند.

لیزه مایتنر”
لیزه مایتنر (به آلمانی: Lise Meitner) (۱۸۷۸-۱۹۶۸) فیزیکدان اتریشی، و بعدها سوئدی بود.
در سال ۱۸۷۸ در خانوادهای هشت نفری به دنیا آمد و با تمام مشکلاتی که به خاطر زن بودنش بر سر راه ورود وی به دانشگاه وجود داشت، در سال ۱۹۰۱ وارد دانشگاه وین شد. در این دانشگاه ٬ تحت نظارت لودویگ بولتزمان یکی از فیزیکدانان به نام دنیا در رشته فیزیک تحصیل کرد و در سال ۱۹۰۷ دکترای خود را گرفت.
لیزه به همراه همکارش اتو هان اولین کسانی بودند که شکافت هستهای را توضیح دادند. آنها در سال ۱۹۳۹ در مجله طبیعت (Nature) مقاله معروف خود را در مورد شکافت هستهای ارائه دادند و بدین ترتیب راه را برای استفاده از این انرژی گشودند. به همین دلیل ٬پس از جنگ جهانی دوم به مایتنر لقب «مادر بمب اتمی» دادهشد. در سال ۱۹۴۴ جایزه نوبل شیمی به اوتو هان داده شد گرچه بسیاری مایتنر و هان هردو را شایسته دریافت این جایزه میدانستند
ویلهلم رونتگن
ویلهلم کنراد رونتگن (به آلمانی: Wilhelm Conrad Röntgen) فیزیکدان آلمانی و کاشف اشعه ایکس است که اولین جایزه نوبل فیزیک را در سال ۱۹۰۱ به دست آورد.
رونتگن در ۲۷ مارس ۱۸۴۵ در شهر لنپ در کشور آلمان متولد شد. رونتگن تحصیلات ابتدایی خود را در هلند گذرانید و سپس به سوییس مسافرت کرد و وارد انستیتو تکنولوژی فدرال سوئیس شد و تحت نظر پروفسور آدولف کلاسیوس به تحصیل ادامه داد. پس از اتمام تحصیلات موفق به اخذ درجه دکترا در رشته فیزیک گردید و به وورتسبورگ آلمان بازگشت. بعد از اینکه مدتی در دانشگاههای استراسبورگ و دانشگاه گیسن تدریس کرد استاد دانشگاه وورتسبورگ گردید و در یکی از ایام سال ۱۸۹۵ به این شهر هنگام تکرار تجربه لنار، با نمودی مواجه شد که نزدیک بود از شدت تعجب و حیرت بر جای خشک شود.
رونتگن لوله کروکس خود را در کاغذ سیاهی پیچیده بود و با این حال مشاهده کرد که پرده آغشته به یک ماده فلوئورسنت که در نزدیکی لوله قرار داشت بدون علتی روشن میشود. بعد از اینکه تجربه را چند بار متوالی تکرار کرد چنین نتیجه گرفت که این عامل اسرارآمیز از کاتد صادر نمیشود بلکه از صفحه آلومنیوم یا آنتی کاتد ساطع میشود. بدین ترتیب رونتگن اشعهای کشف کرد که معلوم نبود چیست؛ لذا آن را اشعه ایکس یا اشعه مجهول خواند.
مطالعات و اکتشافات
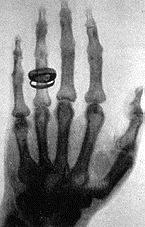
تصویر دست همسر رونتگن در سال ۱۸۹۶ یکی از اولین تصاویر عکاسی شده به وسیله اشعه ایکس
مطالعات رونتگن بیشتر دربارهٔ الکتریسیته و نور و گرما بود و بالاخره در تعقیب مطالعات سر ویلیام کروکس موفق به کشف اشعه ایکس شد.
کشف رونتگن اولین کشف از سری کشفیات در مورد رادیو اکتیویته بود که شامل کشفیات بکرل، کوری، رادرفورد، ماکس پلانک، تامسون، انیشتین و انریکو فرمی میشد.
اشعه X اشعهای با طول موج بسیار کوتاه و قابلیت نفوذ بسیار زیاد است و از اغلب مواد عبور میکند. فیزیکدانان برای آنالیز مواد بلوری استفادههای شایانی از این اشعه بردهاند و در پزشکی تحت عنوانهای رادیوگرافی و رادیوسکوپی به کار برده میشود.
در هشتم نوامبر ۱۸۹۵ میلادی رونتگن استاد فیزیک دانشگاه ورسبورک آلمان سرگرم انجام تجربیات روی اشعه کاتد یک با لوله کروکس-هیتورف (crookes hittorf tube) بود. این نوح لوله که در آن زمان بکرات مورد استفاده فیزیکدانان قرار می کرفت شامل حباب شیشهای بود که تقریبأ هوای آن تخلیه کامل گشته و دو الکترود به فاصله چند سانتیمتر از یکدیگر در آن قرار داشت. با برقراری اختلاف پتانسیل زیادی در حدود چندین هزار وت بین الکترودها، اشعه کاتدیک (الکترونها) از کاتد (الکترود منفی) به طرف آند (الکترود مثبت) رهسپار میگردد، یا به عبارت دیگر به مسیر خود ادامه میدهد تا به بجدار شیشه لوله اصابت نماید. رونتگن در صفحه کاغذ آغشته به کریستالهای پلاتینیو سیانور بارپمکه در مجاورت لوله کروکس-هیتورف قرار داشت فلور سانس درخشانی مشاهده نمود. بلافاصله وی به شناخت اشعه نوینی به مراتب نافذتر از اشعه کاتدیک رهنمون گردید. سپس رونتگن مشتاقانه در طی چند هفته با پیگیری مداوم این ایده و با طرح تجربیاتی دقیق، به بررسی صفات این اشعه که آن را اشعه ایکس نامید، پرداخت. کشف اشعه ایکس و کاربرد وسیع آن در تصویر برداری پزشکی باعث نجات جان انسانهای زیادی گردید بطوریکه در حال حاضر تصور علم پزشکی بدون تصویر برداری با اشعه ایکس غیرممکن میباشد.
افتخارات
رونتگن در سال ۱۸۹۶ به خاطر کشف مهمش یعنی اشعه X، نشان رامفورد را بدست آورد. او در سال ۱۹۰۱ اولین جایزه نوبل فیزیک را بدست آورد.

نیکلاس کوپرنیک (به لهستانی: Mikołaj Kopernik)، (به آلمانی: ، Nikolaus Kopernikus)[۱][۲][۳] ;[۴] (۱۹ فوریه ۱۴۷۳ – ۲۴ مه ۱۵۴۳) ستارهشناس، ریاضیدان و اقتصاددانی لهستانی–آلمانی بود که نظریه خورشید مرکزی منظومه شمسی را گسترش داد و به صورت علمی درآورد. وی پس از سالها مطالعه و مشاهده اجرام آسمانی به این نتیجه رسید که بر خلاف تصور پیشینیان زمین در مرکز کائنات قرار ندارد، بلکه این خورشید است که در مرکز منظومه شمسی است و سایر سیارات از جمله زمین به دور آن در حال گردشند.
نظریهٔ انقلابی کوپرنیک یکی از درخشانترین مستندسازیهای عصر رنسانس است که نه فقط آغازگر ستارهشناسی نوین بود، بلکه دیدگاه بشر را دربارهٔ جهان هستی دگرگون کرد.[۵
نیکلاس کوپرنیک در شهر تورون در لهستان متولد گردید. پدرش یک تاجر مس ثروتمند و از محترمین تورون بود که در سال ۱۴۶۰ از کراکف (پایتخت آن زمان لهستان) به آن شهر مهاجرت کرده بود.
وقتی کوپرنیک ده ساله بود، پدرش درگذشت و داییاش لوکاس واتزنرود – که اسقفی در پروس شرقی بود- سرپرستی او، برادر و دو خواهرش را به عهده گرفت. واتزنرود میخواست که کوپرنیک روزی به مقام کشیشی برسد؛ از این رو در ۱۴۹۱ وی را برای تحصیل علوم دینی و ریاضیات به دانشگاه یاگیلونیا در کراکف فرستاد. در آنجا بود که کوپرنیک توسط معلمش آلبرت برودزوسکی با ستارهشناسی آشنا و به آن علاقهمند شد. پس از پایان تحصیلات چهار ساله و توقفی کوتاه در تورون، کوپرنیک رهسپار ایتالیا شد تا در دانشگاههای بولونیا و دانشگاه پادوا حقوق و پزشکی بخواند. سپس برای ادامه تحصیل در فقه و حقوق مدنی به فرارا رفت؛ اما پس از ملاقات با ستارهشناس مشهور «دومنیکو نووارا دو فرارا» سر درس او حاضر و دستیارش شد. در ۱۴۹۷ واتزنرود به مقام اسقفی در وارمیا برگزیده شد و جایی نیز برای کوپرنیک به عنوان کشیش عالیرتبه در کلیسای جامع فرومبورک خالی شد؛ ولی او با اجازه کلیسا چند سال دیگر در ایتالیا ماند و در ۱۵۰۳ در رشته فقه درجه دکتری گرفت. وی همچنین در مدت اقامتش در پادوا فرصت یافت تا با مطالعه آثار سیسرو و افلاطون از آراء گذشتگان دربارهٔ حرکات کره زمین آگاهی یابد و طرح اولیه نظریه خود را شکل دهد. در ۱۵۰۵ کوپرنیک برای زندگی و کار به فرومبورک رفت و بعدها در کلیسا و حکومت مسؤولیتهای متعددی را پذیرا شد. اصلاح نظام پولی حکومت پروس و انتشار رسالاتی دربارهٔ ارزش پول از جمله خدمات او در این مدت است. در جریان جنگ میان توتونها و پادشاهی لهستان (۱۵۲۴–۱۵۱۹) کوپرنیک فرماندهی دژ وابستگان کلیسا را در شهر مرزی آلنشتاین به عهده داشت و تا زمان اعلام آتشبس در سال بعد با موفقیت از شهر دفاع کرد.
در طول این سالها کوپرنیک همچنان اوقات فراغتش را با ستارهشناسی میگذراند و از فراز رصدخانه سادهای که خو د ساخته بود حرکات اجرام آسمانی ر ا مطالعه و با جدولهای نجومی قدیمی مقایسه میکرد. مانند دیگر منجمان غربی مرجع و راهنمای کوپرنیک نیز کتاب المجسطی نوشته بطلمیوس ستارهشناس معروف قرن اول اسکندریه بود. بطلمیوس در این کتاب با فرضِ قرار گرفتن زمین در مرکز عالم، موقعیت سیارات و حرکات افلاک آنها را در آسمان محاسبه کرده بود.
زمینههای فکری کوپرنیک:
از نخستین اشخاصی که پی به نادرست بودن نظریهٔ زمین مرکزی برد دانشمندی به نام آریستارخوس بود همچنین فیثاغورس هم اشارهای به نظریهٔ خورشید مرکزی کرده بود ۱) ستارهشناسان دورهٔ اسلامی از زمان ابن هیثم به تناقضات فیزیکی و فلسفی موجود در مدل بطلمیوس پی برده و تلاشهای بسیاری برای حل آن از خود نشان داده بودند. خواجه نصیرالدین طوسی، قطبالدین شیرازی و مؤیدالدین عرضی از جمله کسانی بودهاند که در رصدخانهٔ مراغه به تهیه و تنظیم مدلهای جدید غیربطلمیوسی برای حل این مشکلات پرداختند. این مدلها توسط کسانی مانند ابن شاطر دمشقی در قرون بعدی به اوج خود رسید. اگر چه تمام این مدلها همچنان زمین مرکزی بودند، ولی تناقضات مدل بطلمیوسی را حل مینمودند.
کوپرنیک نیز با همین انگیزه دست به کار شد تا مدلی غیر بطلمیوسی برای عالم تنظیم کند، و امروزه میتوان ردپای دستاوردهای منجمین مکتب مراغه را در کارهای وی مشاهده کرد.
- از طرف دیگر، کوپرنیک شدیداً تحت تأثیر تفکرات فیثاغورثی رایج در عصر خود بود. طبق این دیدگاه طبیعت همیشه منطبق بر سادهترین نظریه است و همیشه طبق روش هندسی و ریاضی و عددی قابل شناخت و بررسی است.
- همچنین فیثاغورثیان باستان ارزش بسیاری برای خورشید قائل بودند و آن را مقدس میدانستند. کوپرنیک نیز با برخورداری و اعتقاد از الهیات مسیحی معتقد بود که خورشید نماد مادی خدای پدر است و بسیار بجاست که شکوه و عظمت خدای پدر در خورشید آسمان تجلی بیابد. در نتیجه، عقل نمیپسندید که خورشید با تمام قداست و شکوهش در جایی جز در مرکز عالم، قرار گیرد.
۴) وی میدانست که برخی از فلاسفه یونان ادعا کرده بودند زمین حرکت میکند. به عقیدهٔ او نظر درستتر آن بود که خورشید در مرکز عالم و زمین مانند دیگر سیارات بدور خورشید در حرکت باشد. نظریهٔ او بسیار انقلابی بود زیرا هم با اصول پذیرفته شده نجوم بطلمیوسی در تعارض بود و هم با نص کتاب مقدسی که معلوم نبود مورد تحریف واقع شده یا خیر ,, به هر حال ور قدیسان کلیسا بر این بود .
در سال ۱۵۱۴ کوپرنیک دست نوشتهٔ کوتاهی را بین دوستان خود توزیع کرد که در آن دیدگاههایش را دربارهٔ فرضیهٔ خورشید مرکزی به اختصار بیان کرده بود. نوشتهٔ کوتاه کوپرنیک با استقبال زیادی روبرو شد و او را در جمع دانشمندان اروپایی نامآور گردانید. اما کوپرنیک هنوز نظریهاش را قابل عرضه در محافل علمی نمیدانست و سالهای بعد را صرف مشاهدات دقیق و جمعآوری شواهد و مدارک کرد تا به آن اعتبار بیشتری بخشد. در سال ۱۵۳۳ شهرت کوپرنیک به جایی رسیده بود که آلبرت ویدمانشتات منشی پاپ کلمنت هفتم یک رشته سخنرانی دربارهٔ نظریهٔ او برای پاپ و گروهی از کاردینالها در واتیکان ترتیب داد.
در ۱۵۳۶ که تحقیقات کوپرنیک به اتمام رسید دیگر در اروپا دانشمندی نبود که دربارهٔ نظریهٔ انقلابی او چیزی نشنیده باشد و بسیاری در گوشه و کنار قاره خواستار انتشار آن بودند. او حتی در کلیسا نیز حامیان پرنفوذی داشت؛ کاردینال نیکلاس فون شونبرگ در نامهای خطاب به کوپرنیک نوشت: «… ای مرد فاضل! امیدوارم که تقاضای مرا بیجا ندانی ولی مؤکداً از تو استدعا میکنم که کشف خود در باب کائنات را در معرض قضاوت دیگر نخبگان جهان قرار دهی و ضمناً در اولین فرصت ممکن شرحی از نظریهٔ خود را همراه با جداول و هرچه که به آن مربوط است برای من ارسال داری…»
این نامه تشویقآمیز اگر چه برای کوپرنیک بسیار ارزشمند بود ولی کافی نبود تا او را به انتشار نظریهٔ انقلابیاش متقاعد کند. وی همچنان به تکمیل تحقیقات خود ادامه داد تا سال ۱۵۳۹ که با ریاضیدانی به نام گئورگ یواخیم رتیکوس آشنا گردید که او را به شاگردی پذیرفت. این دو با هم نظریهٔ جدید را مطالعه کردند. پس از دو سال رتیکوس با استفاده از اصول تئوری کوپرنیک کتاب ناراتیو پریما را دربارهٔ حرکت زمین نوشت و در ۱۵۴۲ به نام کوپرنیک بخشی از پژوهش او در مثلثات را منتشر کرد. در برابر اصرار شدید رتیکوس بالاخره کوپرنیک پذیرفت که شرح کاملی دربارهٔ نظریهٔ خود فراهم کند و آن را به نورنبرگ بفرستد تا با نظارت او به چاپ رسد. سرانجام کتاب در ۱۵۴۳ منتشر شد. کوپرنیک اندکی پس از آن در ۲۴ مه همان سال در گذشت. میگویند اولین نسخه در زمانی به دست کوپرنیک رسید که وی در بستر مرگ بود.
مهمترین وقایع زندگی
- ۱۴۹۱–۹۴: در دانشگاه کراکف در لهستان در رشتههای ریاضی و نورشناسی به تحصیل میپردازد.
- ۱۴۹۶: در دانشگاه بولونیا در ایتالیا در رشته قوانین شریعت و ستارهشناسی مشغول تحصیل میشود.
- ۱۴۹۷: کشیش کلیسای فرومبورک در اتریش میشود. این سمت را تا پایان عمرش حفظ میکند.
- ۱۵۰۱–۱۵۰۵: در دانشگاه پادوا در ایتالیا در رشتههای حقوق، زبان یونانی و پزشکی مشغول تحصیل میشود.
- ۱۵۰۶: به فرومبورک بازمیگردد. او بیشتر به عنوان یک پزشک و مردی روحانی شناخته میشود تا یک ستارهشناس.
- ۱۵۰۶–۱۲: به عنوان پزشک و منشی عمویش کار میکند.
- ۱۵۱۲: کار بر روی نظریه خود مبنی بر مرکزیت خورشید در منظومه شمسی را آغاز میکند.
- ۱۵۳۰: کارش را کامل میکند ولی منتشر نمیسازد.
- ۱۵۴۳: در تاریخ ۲۴ مه در فرومبورک از دنیا میرود. کمی قبل از مرگش یک نسخه چاپ شده از کتاب جدیدش را که عنوان آن گردش افلاک آسمانی بود دریافت میکند.
- ۱۶۱۶: چاپ و فروش کتاب وی از سوی کلیسای کاتولیک رم ممنوع میشود. این ممنوعیت تا سال ۱۸۳۵ادامه مییابد.
گئورگی فلِروف”
گئورگی فلِروف (روسی: Гео́ргий Никола́евич Флёров؛ IPA: [gʲɪˈorgʲɪj nʲɪkɐˈlajɪvʲɪtɕ ˈflʲɵrəf]؛ زاده ۲ مارس ۱۹۱۳ درگذشته ۱۹ نوامبر ۱۹۹۰) یک فیزیکدان هستهای اهل روسیه بود.
او در سال ۱۹۴۰ میلادی به همراه کنستانتین پترزاخ توانست برای نخستین بار فرایند واپاشی هستهای شکافت خود به خود را مشاهده نماید.[
انشاءالله در مقاله های بعدی به خواص ردیف به ردیف جدول تناوبی و قابلتها وتوانمندی و کاربردهای هر عنصر خواهیم پرداخت .
امیدواریم با این توضیحاتی که قلم زدیم اشنایی بیشتری را با این علم برای شما فراهم اورده باشیم .
ازخدا خواهیم توفیق عمل .
دپارتمان فنی مهندسی شرکت پراگ
محقق : دکتر هاشم ابهری




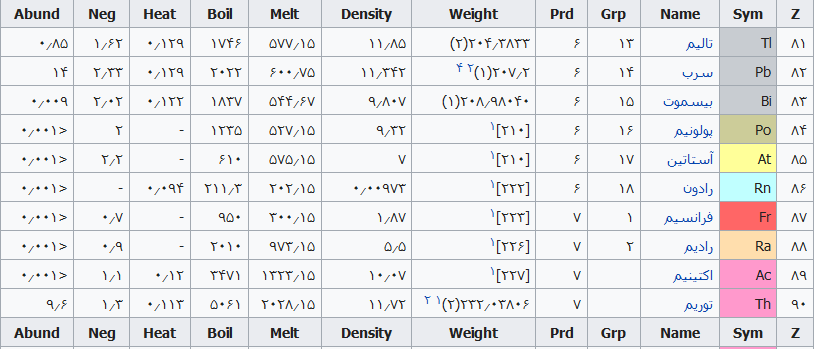

دیدگاهتان را بنویسید